مقالات
از PCR دیجیتال تا CRISPR و NGS: راهنمای کامل تجهیزات مولکولی و تشخیص دقیق بیماریها
روش های مولکولی
در دنیای امروز، پیشرفتهای سریع در علم زیستفناوری و ژنتیک باعث شدهاند که روشهای سنتی تشخیص بیماری دیگر پاسخگوی نیازهای پزشکی دقیق و شخصیسازیشده نباشند. پزشکان و پژوهشگران اکنون به دنبال ابزارهایی هستند که بتوانند اطلاعات دقیقتری از ژنوم، بیان ژنها و جهشهای مولکولی در سطح سلولی فراهم کنند. در این میان، روشهایی مانند توالییابی نسل جدید (NGS)، PCR دیجیتال و CRISPR تشخیصی توانستهاند انقلابی در تشخیص مولکولی ایجاد کنند و آزمایشگاههای تحقیقاتی و بالینی را وارد عصر جدیدی از دقت و سرعت نمایند.
اگر به روند رشد بازار تجهیزات آزمایشگاهی در دهه گذشته نگاه کنیم، خواهیم دید که بخش مربوط به تجهیزات تشخیص مولکولی، یکی از سریعترین رشدها را داشته است. علت این رشد تنها افزایش بیماریها نیست، بلکه تغییر نگاه به درمان بر اساس ژنوم فردی است. پزشکی امروز دیگر تنها به علائم ظاهری تکیه نمیکند، بلکه به دنبال بررسی عمیق DNA و RNA برای کشف دلایل ریشهای بیماری است. در چنین شرایطی، روشهای مولکولی نسل جدید ابزارهایی هستند که میتوانند با حساسیت و دقت بسیار بالا، حتی کوچکترین تغییرات ژنتیکی را شناسایی کنند.
یکی از مهمترین دلایل اهمیت این روشها، سرعت در تشخیص بیماریها است. در گذشته، تشخیص برخی بیماریهای ویروسی یا ژنتیکی ممکن بود هفتهها طول بکشد. اما با فناوریهایی مثل NGS، میتوان در کمتر از ۴۸ ساعت توالی کامل ژنوم یک ویروس یا سلول سرطانی را تعیین کرد. این سرعت بالا، نهتنها برای تصمیمگیری درمانی حیاتی است، بلکه در کنترل اپیدمیها و طراحی واکسن نیز نقش مهمی دارد. نمونه بارز آن، اپیدمی کووید-۱۹ بود که نشان داد آزمایشگاههایی که به فناوری NGS مجهز بودند، سریعتر قادر به شناسایی و ردیابی جهشهای ویروسی بودند.
در کنار سرعت، دقت و قدرت تفکیک این روشها نیز نقطه قوت بزرگی است. بهعنوان مثال، روش PCR دیجیتال قادر است تنها با چند مولکول DNA، وجود یک جهش خاص را تشخیص دهد؛ قابلیتی که در روشهای سنتی مانند qPCR بهسختی قابل دستیابی بود. در حوزههایی مانند انکولوژی (تشخیص سرطان) یا تشخیص عفونتهای خفیف ویروسی، این دقت بالا میتواند تفاوت میان یک تشخیص موفق یا اشتباه را رقم بزند.
روش دیگر، یعنی CRISPR تشخیصی، نسل جدیدی از ابزارهای زیستی است که از سیستمهای دفاعی طبیعی باکتریها الهام گرفته شده است. این فناوری در واقع به ما اجازه میدهد که با استفاده از آنزیمهای خاص، توالیهای ژنتیکی بیماریزا را مانند یک “مگسکش مولکولی” هدف قرار داده و شناسایی کنیم. مزیت بزرگ CRISPR در سادگی، سرعت و هزینه پایین آن است. همین ویژگیها باعث شدهاند که محققان از آن بهعنوان نسل آینده تستهای خانگی تشخیصی نام ببرند.
از سوی دیگر، رشد این فناوریها تأثیر مستقیمی بر بازار تجهیزات آزمایشگاهی گذاشته است. شرکتهای فعال در زمینه فروش تجهیزات مولکولی، اکنون با افزایش تقاضا برای دستگاههای PCR دیجیتال، توالییابهای NGS و کیتهای CRISPR مواجهاند. مشتریان عمده این محصولات نهتنها دانشگاهها و مراکز تحقیقاتی هستند، بلکه آزمایشگاههای تشخیص طبی، بیمارستانها و حتی استارتآپهای حوزه بیوتکنولوژی نیز بهدنبال خرید و تجهیز آزمایشگاههای مولکولی خود میباشند. بنابراین، آگاهی از مبانی علمی این روشها برای خریداران تجهیزات نیز ضروری است، چون انتخاب دستگاه مناسب میتواند بر دقت نتایج، هزینه آزمایشها و حتی موفقیت پروژههای تحقیقاتی تأثیر مستقیم داشته باشد.
PCR کلاسیک
در اواسط دههی ۱۹۸۰، اختراعی در دنیای زیستفناوری به ثبت رسید که مسیر تحقیقات ژنتیکی و تشخیص بیماریها را برای همیشه تغییر داد. این اختراع، واکنش زنجیرهای پلیمراز یا همان PCR (Polymerase Chain Reaction) بود؛ روشی که به دانشمندان اجازه میداد در مدت زمان کوتاهی، میلیونها نسخه از یک قطعه خاص DNA را تکثیر کنند. این کشف، که حاصل کار کاری مولیس (Kary Mullis) بود، انقلابی در آزمایشگاههای مولکولی ایجاد کرد و بعدها جایزه نوبل را برای او به ارمغان آورد. امروزه تقریباً هیچ آزمایشگاه مولکولی بدون دستگاه PCR فعالیت نمیکند و این روش بهعنوان ستون اصلی در تحقیقات ژنتیکی، تشخیص بیماریها، شناسایی میکروارگانیسمها و حتی جرمشناسی شناخته میشود.
اصل کار PCR بر پایهی شبیهسازی فرآیند طبیعی همانندسازی DNA در سلول است. در این روش، با استفاده از آنزیم DNA پلیمراز مقاوم به حرارت، بخش خاصی از DNA هدف در دمای بالا جدا و سپس در دمای پایینتر توسط پرایمرها تکثیر میشود. این فرآیند شامل سه مرحلهی اصلی است: دناتوراسیون (جدا شدن دو رشته DNA)، اتصال پرایمرها (Annealing) و طولانی شدن زنجیرهی جدید DNA (Extension). این چرخه معمولاً در حدود ۳۰ تا ۴۰ بار تکرار میشود و نتیجه آن، تولید میلیاردها نسخه از همان بخش DNA مورد نظر است. این حجم عظیم از مولکولهای DNA امکان مطالعهی دقیق توالیها، بررسی وجود ژنهای خاص یا تشخیص پاتوژنها را فراهم میکند.
با وجود تمام مزایای خود، PCR سنتی دارای محدودیتهایی است که به مرور زمان محققان را به سمت توسعهی روشهای دقیقتر و حساستر سوق داد. یکی از مهمترین محدودیتها، غیرکمی بودن نتایج است. در PCR معمولی تنها میتوان حضور یا عدم حضور یک توالی خاص را مشاهده کرد، اما مقدار دقیق آن قابل اندازهگیری نیست. این موضوع در تشخیص بیماریها یا تعیین بار ویروسی میتواند بسیار حیاتی باشد، زیرا در بسیاری از موارد، دانستن میزان DNA یا RNA هدف تعیینکنندهی شدت بیماری است.
از دیگر محدودیتهای روش سنتی، احتمال آلودگی نمونهها است. چون PCR میتواند حتی از چند مولکول DNA، نسخههای زیادی تولید کند، هرگونه آلودگی محیطی میتواند نتایج را بهشدت تحت تأثیر قرار دهد. در آزمایشگاههایی که تهویه و تقسیمبندی مناسب ندارند، این آلودگیها ممکن است به راحتی از یک واکنش به واکنش دیگر منتقل شوند. به همین دلیل، امروزه آزمایشگاههای مولکولی مدرن برای اجرای PCR از سیستمهای تهویه HEPA، فیلترهای مخصوص، هودهای ایزوله و دستکشهای ضدآلودگی استفاده میکنند.
مشکل دیگر، وابستگی به کنترلهای مثبت و منفی است. در PCR کلاسیک اگر کنترلها به درستی طراحی یا اجرا نشوند، نتایج بهراحتی میتوانند گمراهکننده باشند. برای مثال، یک واکنش منفی ممکن است بهخاطر خطای پرایمرها یا کاهش کارایی آنزیم منفی شود و نه بهخاطر نبود هدف ژنتیکی. از سوی دیگر، واکنش مثبت کاذب نیز در اثر آلودگی یا اتصال غیراختصاصی پرایمرها ایجاد میشود. همهی این عوامل باعث شدهاند که PCR سنتی در بسیاری از موارد تنها بهعنوان روش اولیهی غربالگری به کار رود و برای تأیید نتایج نیاز به روشهای مکمل باشد.
یکی از محدودیتهای مهم دیگر، عدم توانایی PCR سنتی در شناسایی همزمان چند هدف ژنتیکی است. اگرچه با طراحی چند پرایمر مختلف میتوان تا حدی چند توالی را همزمان بررسی کرد، اما تداخل بین واکنشها باعث کاهش حساسیت میشود. این ضعف بعدها با ابداع تکنیکهایی مانند Multiplex PCR تا حدودی برطرف شد، اما همچنان محدودیتهایی از نظر دقت و تحلیل داده وجود دارد. این مسئله اهمیت خود را در بیماریهایی مانند عفونتهای ویروسی چندگانه یا تشخیص جهشهای ژنتیکی متنوع نشان میدهد، جایی که باید چندین هدف مختلف را در یک نمونه به طور همزمان بررسی کرد.
همچنین، در PCR کلاسیک معمولاً نتایج در پایان واکنش و با استفاده از الکتروفورز ژل آگارز مشاهده میشوند. این روش زمانبر است و خطر آلودگی ثانویه نیز دارد، چون نیاز به باز کردن لولههای واکنش دارد. علاوه بر آن، تفسیر نتایج با چشم یا تصویر ژل ممکن است خطای انسانی ایجاد کند. به همین دلیل، نسل بعدی PCR یعنی Real-Time PCR (qPCR) توسعه یافت تا بتواند میزان DNA را در طول واکنش و بهصورت کمی اندازهگیری کند. هرچند qPCR گامی بزرگ در پیشرفت تکنیکهای مولکولی بود، اما همچنان محدودیتهایی داشت که زمینهساز تولد فناوری PCR دیجیتال شد.
PCR دیجیتال
فناوری PCR دیجیتال (dPCR) را میتوان نسل پیشرفته و دقیقتر از qPCR دانست که برای اندازهگیری مطلق DNA و RNA با بالاترین حساسیت طراحی شده است. برخلاف PCR سنتی که نتایج را بهصورت نسبی ارائه میدهد، در dPCR نمونه به هزاران واکنش کوچکتر تقسیم میشود؛ بهطوریکه هر قطره یا میکروچمبر تنها شامل تعداد اندکی از مولکولهای DNA است. در پایان واکنش، هر بخش بهصورت دیجیتال با پاسخ «مثبت» یا «منفی» آنالیز میشود و همین فرآیند باعث میشود که بتوان تعداد دقیق مولکولهای ژنتیکی را بدون نیاز به منحنی استاندارد محاسبه کرد. این ویژگی، dPCR را به ابزاری بسیار ارزشمند در تشخیص جهشهای نادر، تحلیل بیان ژن و بررسی تعداد نسخههای ژنی (Copy Number Variation) تبدیل کرده است.
یکی از پرکاربردترین زمینههای استفاده از PCR دیجیتال، تشخیص سرطان و بیماریهای ویروسی است. در انکولوژی، این فناوری به پزشکان اجازه میدهد حتی جهشهای ژنی با فراوانی کمتر از ۰.۱ درصد را شناسایی کنند؛ چیزی که با qPCR معمولی غیرممکن است. همچنین در حوزهی بیماریهای عفونی مانند HIV، هپاتیت B و SARS-CoV-2، از dPCR برای اندازهگیری دقیق بار ویروسی و رصد اثربخشی درمان استفاده میشود. این دقت بالا باعث شده بسیاری از آزمایشگاههای تشخیص طبی پیشرفته و مراکز تحقیقاتی ژنتیک، دستگاههای PCR دیجیتال را به فهرست تجهیزات ضروری خود اضافه کنند. در بازار تجهیزات آزمایشگاهی ایران نیز، جستوجو برای «خرید دستگاه PCR دیجیتال» و «کیت dPCR» طی سالهای اخیر افزایش چشمگیری داشته است.
از منظر فنی، dPCR علاوه بر دقت بالا، مزایایی مانند مقاومت در برابر مهارکنندهها، قابلیت تشخیص نمونههای با غلظت پایین و تکرارپذیری بالا دارد. اما هزینه تجهیزات و نیاز به تخصص در تحلیل داده، هنوز از چالشهای اصلی این فناوری محسوب میشود. با این حال، با کاهش قیمت پلتفرمهای جدید و توسعه نرمافزارهای تحلیل خودکار، انتظار میرود در آیندهای نزدیک، PCR دیجیتال جایگزین روشهای کلاسیک در بسیاری از کاربردهای تشخیصی شود. در واقع، این فناوری مسیر را برای روشهای ترکیبی نسل بعد، مانند dPCR-NGS و CRISPR-PCR هموار کرده است و پایهای برای تحول در دنیای آزمایشگاههای مولکولی مدرن به شمار میرود.
توالی یابی نسل جدید
توالییابی نسل بعد (NGS) فناوریای است که امکان تعیین همزمان میلیونها توالی DNA یا RNA را در یک واکنش واحد فراهم میکند. برخلاف روش سنتی Sanger sequencing که تنها یک توالی را در هر بار میخواند، NGS با استفاده از پلتفرمهای موازیسازی بالا مانند Illumina، Ion Torrent، Oxford Nanopore و PacBio میتواند در مدت چند ساعت ژنوم کامل انسان یا یک ویروس را توالییابی کند. این فناوری باعث کاهش چشمگیر هزینه و زمان در مطالعات ژنومی شده و امروزه در حوزههایی چون تشخیص سرطان،
بیماریهای ژنتیکی، متاژنومیکس، توالییابی ویروسها و RNA-Seq کاربرد گسترده دارد. با NGS، پزشکان قادرند جهشهای ژنی، تغییرات ساختاری و بیان ژنها را با دقتی بیسابقه شناسایی کنند؛ به همین دلیل، بسیاری از مراکز تشخیص پیشرفته، آزمایشگاههای تحقیقاتی و حتی شرکتهای داروسازی به استفاده از دستگاههای NGS روی آوردهاند.
انتخاب دستگاه مناسب بستگی به هدف آزمایشگاه دارد؛ برای مثال، Illumina MiSeq برای تحقیقات بالینی کوچک، و NovaSeq یا PromethION برای مراکز بزرگ و پروژههای ژنومی استفاده میشوند. هرچند چالشهایی مانند پردازش دادههای حجیم و نیاز به نرمافزارهای بیوانفورماتیکی وجود دارد، اما مزایای سرعت، دقت و گستره کاربرد NGS آن را به یکی از ستونهای اصلی در تشخیص مولکولی مدرن و آینده پزشکی شخصی تبدیل کرده است.
کریسپر CRISPR
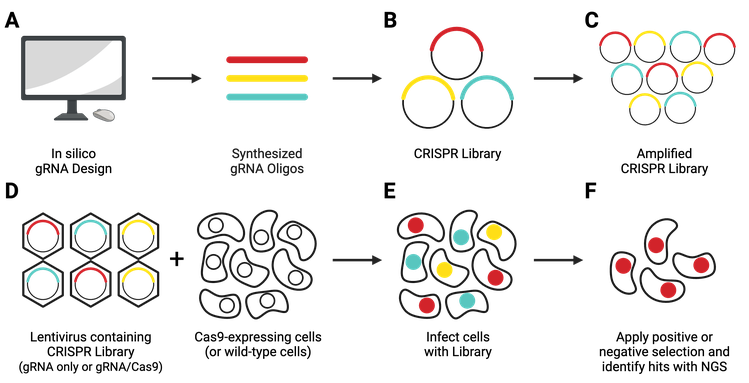
فناوری CRISPR تشخیصی (CRISPR-based diagnostics) برگرفته از سیستم دفاعی طبیعی باکتریهاست که از آنزیمهایی مانند Cas12 ،Cas13 و Cas14 برای شناسایی و برش دقیق توالیهای ژنتیکی استفاده میکند. برخلاف کاربرد ویرایش ژن، در تشخیص مولکولی از توانایی “یافتن و بریدن” توالیهای هدف برای شناسایی بیماریها بهره گرفته میشود. در روشهایی نظیر SHERLOCK، DETECTR و HOLMES، ترکیب CRISPR با فناوریهای تقویتی مانند RPA یا PCR ایزوترمال امکان شناسایی RNA یا DNA ویروسها و باکتریها را در مدت زمان کمتر از یک ساعت فراهم میکند. دقت بالا، هزینه کم و قابلیت اجرای تست در محل (Point-of-Care) از مهمترین ویژگیهای این فناوری است که آن را به گزینهای جذاب برای تشخیص سریع بیماریهایی مانند کووید-۱۹، زیکا، تب دانگ و سرطانهای ژنتیکی تبدیل کرده است.
در سالهای اخیر، بازار جهانی تجهیزات آزمایشگاهی شاهد رشد قابل توجهی در تقاضای کیتهای CRISPR تشخیصی و پلتفرمهای قابل حمل بوده است. این فناوری در مقایسه با PCR دیجیتال و NGS، سادهتر و سریعتر است و به تجهیزات گرانقیمت نیاز ندارد، ازاینرو توجه زیادی از سوی استارتآپهای بیوتکنولوژی و مراکز تشخیص نوآورانه جلب کرده است. انتظار میرود در آینده نزدیک، CRISPR تشخیصی به عنوان پایهای برای تستهای خانگی نسل جدید مورد استفاده قرار گیرد و به استاندارد طلایی در تشخیص سریع، ارزان و دقیق مولکولی تبدیل شود.
همگرایی PCR
در سالهای اخیر، دنیای تشخیص مولکولی شاهد ظهور رویکردی نو به نام تشخیص هیبریدی (Hybrid Diagnostics) بوده است؛ روشی که قدرت تحلیل ژنتیکی فناوریهای PCR دیجیتال، توالییابی نسل بعد (NGS) و CRISPR تشخیصی را با هم ترکیب میکند. در این رویکرد، از PCR دیجیتال برای اندازهگیری دقیق و کمی توالیهای ژنی، از NGS برای شناسایی الگوهای جهشی گسترده، و از CRISPR برای شناسایی سریع و اختصاصی ژنهای هدف استفاده میشود. نتیجهی این همگرایی، سیستمهایی است که میتوانند با سرعت بالا و دقت نانومولکولی، بیماریها را از سطح ژنتیکی تا فنوتیپی شناسایی کنند. این مدل ترکیبی بهویژه در پزشکی شخصی (Personalized Medicine)، تشخیص سرطانهای نادر و بررسی مقاومتهای دارویی اهمیت ویژهای دارد.
فناوریهای هیبریدی با ترکیب توان محاسباتی و بیوانفورماتیکی، در حال ایجاد نسل جدیدی از پلتفرمهای خودکار تشخیصی هستند که از دادهکاوی ژنومی و الگوریتمهای یادگیری ماشین برای تحلیل نتایج استفاده میکنند. شرکتهای تجهیزات آزمایشگاهی اکنون به سمت طراحی دستگاههای ترکیبی پیش میروند که بتوانند همزمان چند فناوری را در یک سیستم مجتمع ارائه دهند. این تحول نشان میدهد آیندهی تشخیص مولکولی نه در رقابت بین روشها، بلکه در ادغام هوشمندانهی آنها است -جایی که دقت، سرعت و هزینه بهینه در کنار هم قرار میگیرند تا استاندارد جدیدی در پزشکی دقیق و آزمایشگاههای هوشمند ایجاد شود.
آینده آزمایشهای مولکولی و روند بازار تجهیزات آزمایشگاهی
آیندهی آزمایشهای مولکولی به سمت یکپارچگی فناوری، خودکارسازی و پزشکی شخصی در حرکت است. ترکیب هوش مصنوعی با فناوریهایی مانند PCR دیجیتال، NGS و CRISPR موجب شده سیستمهای تشخیصی جدید بتوانند بیماریها را با دقت نانومولکولی، در زمان کوتاه و با حداقل مداخله انسانی شناسایی کنند. بازار جهانی تجهیزات آزمایشگاهی نیز بهسمت دستگاههای مولتیآنالیز هوشمند، کیتهای سریع خانگی و پلتفرمهای بیوانفورماتیکی ابری پیش میرود. در این مسیر، آزمایشگاههایی که به سمت دیجیتالیسازی و هوشمندسازی حرکت میکنند، بیشترین مزیت رقابتی را خواهند داشت و نقش کلیدی در آیندهی پزشکی مبتنی بر ژنوم و داده ایفا خواهند کرد.
نتیجهگیری
پیشرفتهای چشمگیر در حوزهی آزمایشهای مولکولی نسل جدید نشان میدهد که تشخیص بیماریها در حال ورود به عصری تازه از دقت، سرعت و شخصیسازی است. از PCR دیجیتال که امکان اندازهگیری دقیق مولکولهای ژنتیکی را فراهم میکند، تا NGS که ژنوم را در ابعاد گسترده میخواند، و CRISPR تشخیصی که تشخیص سریع و قابلحمل را ممکن کرده است - همه و همه در جهت ساخت آیندهای هوشمند برای علوم آزمایشگاهی حرکت میکنند.
ترکیب این فناوریها در سیستمهای هیبریدی، به همراه استفاده از هوش مصنوعی و تحلیل دادههای بیوانفورماتیکی، باعث شده تشخیص مولکولی نهتنها دقیقتر، بلکه مقرونبهصرفهتر و در دسترستر شود. آیندهی این صنعت در دستان آزمایشگاههایی است که بهموقع با این فناوریهای نوین همگام شوند و مسیر پزشکی مبتنی بر ژنوم را با دانش و تجهیزات بهروز دنبال کنند.
چنانچه قصد تجهیز کردن بخش مولکولی آزمایشگاه خود را دارید تیم متخصص و کارشناسان فروش مبنا ژن بصورت رایگان شما را در این زمینه راهنمایی کرده تا بهترین انتخاب متناسب با نیاز خود را داشته باشید.