مقالات
بیماری اوتیسم و علل ابتلا به آن

بیماری اوتیسم یا به طور صحیح تر (Autism spectrum disorder (ASD گروهی از بیماری ها هستند که در آن بیمار، در خود مانده و دچار اختلال رشد در تعاملات اجتماعی، کلامی و مهارت های ارتباطی همراه با رفتارهای کلیشه ای و تکراری می باشد که به دلیل تنوع علائم آن را اختلال طیف اوتیسم می نامند. در سال 1911 اوگن بلولر ( Bleuler ) روان پزشک سوئیسی برای اولین بار این اصطلاح را عنوان کرد. اوتیسم از کلمه اوتوس ( Autos ) یعنی خود گرفته شده است. سپس دکتر لئوکانر و هانس آسپرگر جداگانه علائم این بیماری را به طور دقیق تعریف کردند. این بیماری درجاتی دارد که ممکن است یک نقص ساده باشد که زندگی طبیعی بیمار را تا حدی محدود کند یا ممکن است ناتوانی شدیدی ایجاد کند که به مراقبت های اساسی نیازمند باشد. علائم بیماری معمولا در سه سال اول زندگی بروز می کند و برخی از بیماران حتی قبل از 6 ماهگی برخی از علائم را دارند، این بیماری در پسران معمولا 4 برابر بیشتر از دختران وجود دارد و هیچ برتری یا محدودیت نژادی قومی یا اجتماعی وجود ندارد و در تمام جوامع به طور تقریبا یکسان دیده می شود. میزان درآمد خانواده، سبک زندگی و تحصیلات خانواده نیز بر کودکان مبتلا تاثیری ندارد. این بیماری روند رو به رشدی در تمام جوامع دارد. میزان بروز در آمریکا از سال 1960 بسیار زیاد شده است و در سالهای اخیر 1/5% کودکان در آمریکا دچار این بیماری و از هر 60 کودک یک کودک دچار این بیماری می باشد.
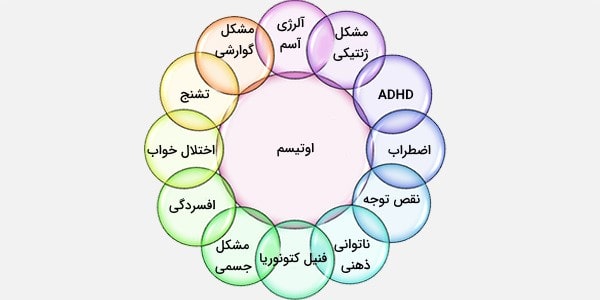
علل ژنتیکی اوتیسم
علل ژنتیکی در حدود 30-35% بیماران یافت می شود و در بقیه بیماران بررسی ها نشان دهنده ترکیبی از عوامل محیطی، موتاسیون های ابتدایی متعدد و واریانت های ژنتیکی نادر می باشد، که هر کدام منجر به بروز اثرات اضافی مربوطه خواهد شد. تلاش ها جهت کشف یک بیومارکر قدرتمند که زمینه تشخیص زودرس و دقیق و در نتیجه مداخلات درمانی سریع تر را فراهم بیاورد همچنان ادامه دارد.
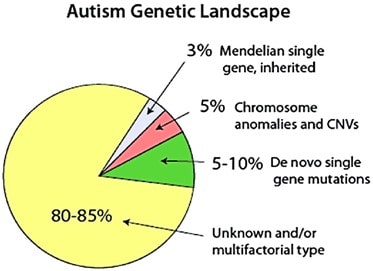
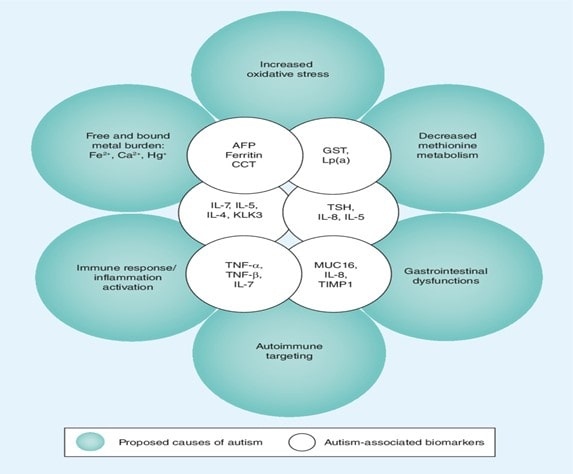
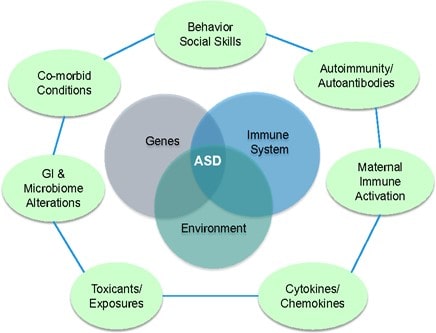
علل و بیومارکرهای اوتیسم
این امکان که تغییر در متابولیسم و آسیب اختصاصی بیوشیمیایی و یا هورمونی می تواند نشان دهنده وجود نارسایی های متابولیکی مشترک در کودکان باشد، زمینه ساز مطالعات متعدد و گسترده ای بوده است که در ذیل به طور مثال به چند نمونه اشاره می شود:
در مطالعه ای اشکالات هموستاز پروتئین منجر به استرس پروتئوتوکسیک و فعال شدن پاسخ پروتئین های غیر تاخورده Unfolded protein response را دلیل ایجاد این بیماری می داند.
در مطالعه ای دیگر با بررسی ادرار و سرم بیماران ASD و مقایسه افراد نرمال Typically developed (TD) افزایش (AGEP ) advanced glycation end products و افزایش اسیدآمینه آرژنین و دی تیروزین را در بیماران ASD گزارش کرده اند و آن را علت اصلی ایجاد علائم بیماری می دانند. (با حساسیت 92% و اختصاصی بودن % 84)
در مطالعه دیگر که روی 213 کودک انجام شده یک الگوی غیر معمول مارکرهای متابولیسم چربی که به نام اسیل کارنیتین می باشد شناسایی شده است و نیز شواهدی از تغییر عملکرد انرژی در رابطه با کاهش گلوتاتیون نیز مشاهده شده است. این مطالعه پیشنهاد میکند که در بعضی بیماران طیف اوتیسم تغییر در عملکرد میتوکندری و متابولیسم چربی به همراه در معرض قرار گرفتن توسط عوامل محیطی دخیل در ایجاد بیماری می باشد .
در تحقیقی دیگر محققین مشاهده کردند که در % 20 از موارد ASD ، تعداد لنفوسیت B، بیست درصد افزایش یافته است و چهل درصد افزایش در سلول های کشنده طبیعی NK Cell نیز موجود بوده و یک افزایش قابل توجه در 100 نوع پروتئین در پلاسما در این بیماران دیده شده است.
در تحقیقی دیگر این گونه اظهار داشتند که در این بیماران به طور بارزی کاهشی در متابولیسم اسیدهای آمینه ال-تریپتوفان داریم. به طوریکه در بیماران ASD متابولیسم اسید آمینه ال-تریپتوفان کاهش می یابد.
در مقاله دیگر با اندازه گیری 24 متابولیت از نمونه خون در ارتباط با چرخه متیونین و مسیر ترانس سولفوراسیون در بین 149 بیمار مشاهده شد. در % 97.6 افراد، این چرخه معیوب است و آنها نتیجه گرفتند که این مسیر محتمل ایجاد این بیماری می باشد.
همچنین در مطالعه ای دیگر این گونه اظهار داشتند که نقص در Folate Dependent One Carbon Metabolism (focm) و ترانس سولفوراسیون (TS ) با دقت حدود % 88 جهت شناسایی ASD قابل مشاهده است و این نتایج را پایه ای برای شناسایی بیوشیمیایی جهت تستی برای تشخیص ASD گذاشتند و نیز توانایی درک ما را از پایه بیوشیمیایی ASD حداقل در یک جزء آن افزایش دادند.
در بررسی دیگر روی 516 بیمار دیل رگولاسیون اسیدهای آمینه که در پلاسما مشاهده گردید، Branched-chain amino acid dysregulation و ترکیب دیس رگولاسیون گلیسین گلوتامین اورنتین با درجه اختصاصی بودن % 96.3 و 93.5% ppv مشاهده شد.
شواهد روبه رشدی از همراهی ASD با مشکلات مسیرهای متابولیکی شامل فولات، متیلاسیون و گلوتاسیون نیز مشاهده شده است و بر اساس آن، چندین آزمون درمانی بر اساس این هدف به انجام رسیده است.
در این روش ترکیب B12 و فولیک اسید با دوز کم ( LDFA ) استفاده شد که این داروها روی چرخه فولات، متیلاسیون و گلوتاتیون موثر بود، که بهبود علائم مشهود بوده است.
مارکرهای وابسته به متابولیسم فولات در بیماران ASD به طور معناداری در بیماران ASD با TD تفاوت داشتند. در این تحقیق % 10 مارکر بیوشیمیایی وابسته به متابولیسم فولات بررسی شد و با حساسیت % 86.5 و اختصاصی بودن % 85.4 اثبات گردید.
در مطالعات متعدد مشاهده گردید که تفاوت معناداری در سطح سرمی 25 هیدروکسی ویتامین D سرمی موجود بوده است. تجویز ویتامین D به این افراد با میزان کمتری از افزایش سطح سرمی ویتامین D همراه بوده و با تجویز میزان قابل توجهی ویتامین D میزان بهبود علائم نیز مشاهده گردید و پیشنهاد شد که سطح سرمی ویتامین D در این افراد در حد 100 - 40 نگه داشته شود.
در مطالعه دیگر کاهش سطح ویتامین D در سرم نوزادان (ماه اول زندگی) با افزایش قابل توجه میزان ریسک ایجاد ASD همراه بوده است. تحقیقات گسترده و همه جانبه در بیماران ASD همچنان ادامه دارد و
محققین از تمام جوانب به این بیماری نگاه کرده و آن را مورد بررسی قرار می دهند. هرچند ما هنوز نتوانسته ایم به یک مارکر قدرتمند جهت شناسایی دقیق، صحیح و به موقع در این بیماری دست یابیم ولی این تحقیقات گسترده یک گام به جلو می باشد. در صورت دستیابی به این مارکر(چه بیوشیمیایی، ژنتیکی، هورمونی و یا غیره) آینده تشخیص و درمان این بیماران را متحول خواهد گردید. اینکه ما بتوانیم این پوسته سخت را بشکافیم و بتوانیم این بیماران را از این حالت در خودماندگی خارج کنیم، به مطالعات پیش رو بستگی خواهد داشت.